Leica TCS SP-5 X
Konfokální mikroskop s vysokým rozlišením Leica TCS SP5 se čtyřmi lasery (bílý laser, UV lasery 355 nm a 405 nm, argonový laser) představuje jedinečné vybavení pro studium biologie chromatinu. Důležitou součástí systému je box, který udržuje podmínky nutné pro kultivaci buněčných linií, a umožňuje tak zkoumat procesy v živých buňkách. Díky tomuto zařízení může naše skupina provádět řadu zajímavých experimentů:
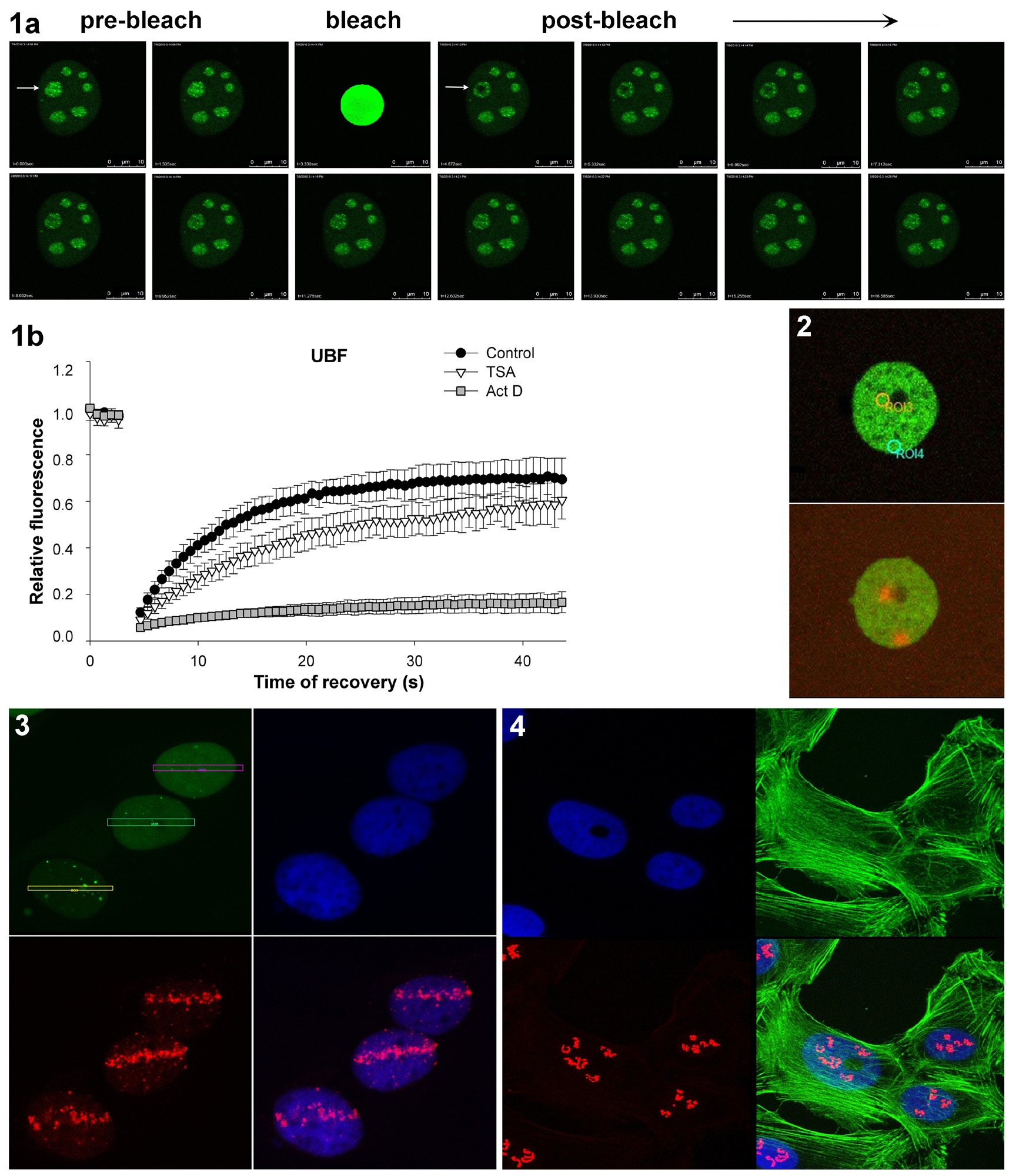
FRAP(Fluorescence Recovery After Photobleaching)
Technika FRAP se používá pro studium dynamiky pohybu molekul jako je difúze, transport nebo jiný druh pohybu fluorescenčně značených molekul v živých buňkách. Principem FRAP je sledování návratu fluorescence po vysvícení (bleachingu) definované oblasti ROI (region of interest) vzorku a její zaznamenání v podobě série obrázků. Návrat fluorescence je důsledkem pohybu nevysvícených molekul z okolního prostředí do vysvícené oblasti. Rychlost tohoto pohybu a míra plně obnovené intenzity fluorescence poskytuje informaci o mobilní/nemobilní frakci fluorescenčně značených molekul. V naší laboratoři používáme FRAP spolu s GFP-technologií ke zkoumání kinetických vlastností proteinů v živých buňkách (Obr. 1). K vysvícení používáme 488-nm argonový laser.
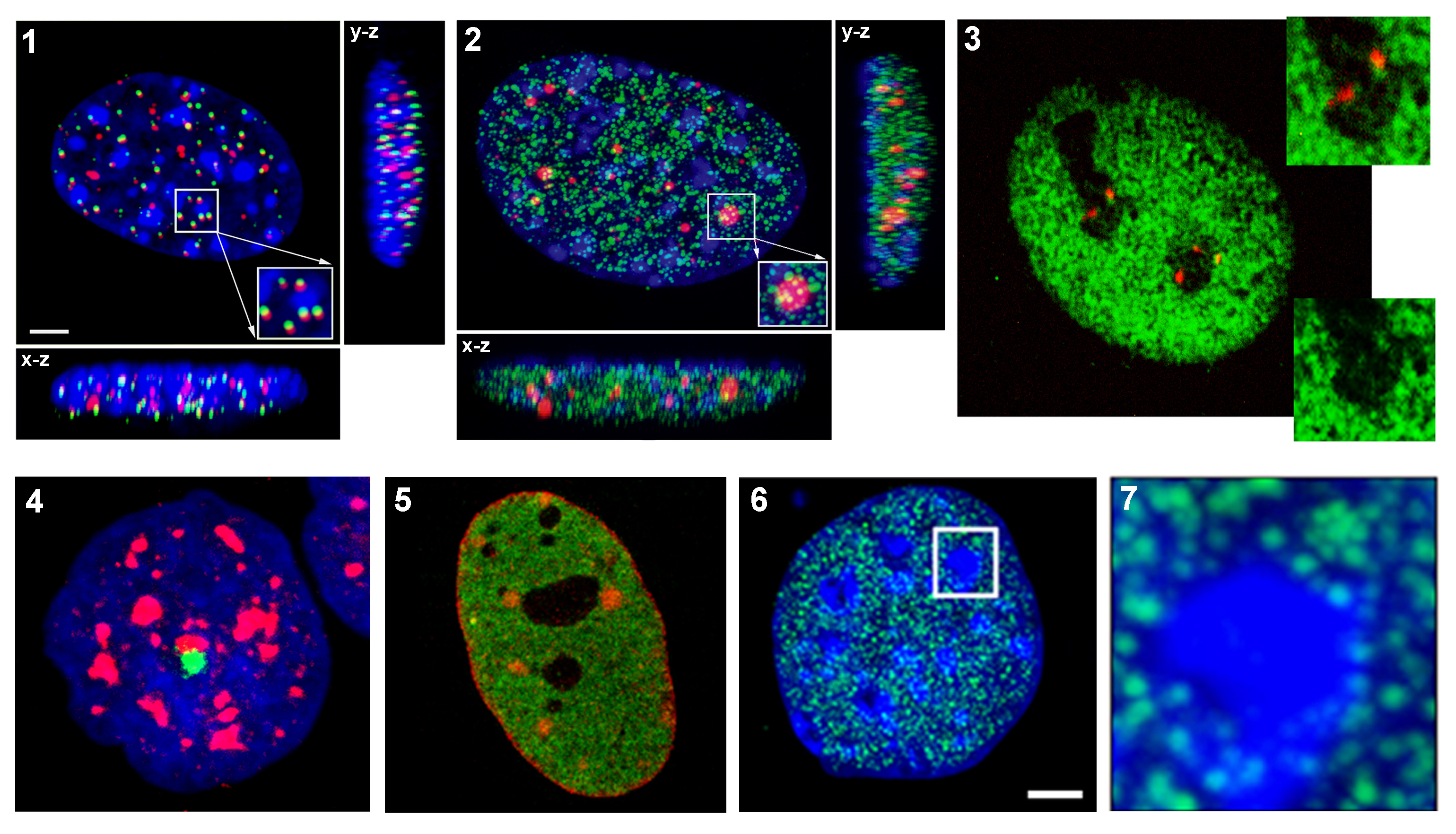
Fotokonverze
Fotokonverze je změna fluorescenčních vlastností fluorochromů po expozici UV laserem (405 nm). V našem případě používáme fluorochrom Dendra2, který vykazuje excitační a emisní maxima při 490 a 507 nm, podobně jako EGFP nebo FITC. Fotokonverze Dendra2 se objeví při vystavení buněk UV záření. Aktivovaný Dendra2 protein je charakteristický excitačními a emisními maximy při 533 a 573 nm. Experimenty na základě fotokonverze umožňují např. sledování pohybu buněk v kolonii, změny v distribuci sub-buněčných struktur a proteinů u mateřské a dceřiných buněk, atd. V naší laboratoři sledujeme v živých buňkách distribuci definované oblasti chromatinu během buněčného cyklu a po různých ovlivněních (Obr. 2).
Indukce dvouřetězcových zlomů v DNA(DSBs - Double Strand Breaks)
Mezi nejčastější příčiny vzniku dvouřetězcových zlomů v DNA patří ionizující záření a chemické látky. Pokud tato poškození nejsou opravena, mohou vést k buněčné smrti nebo k mutaci. Procesy opravy DNA jsou dlouhodobě na vrcholu vědeckého zájmu, a ačkoliv už bylo objeveno mnoho proteinů, které se reparace DNA účastní, stále je potřeba řadu funkčních aspektů objasnit. Pomocí UV laseru (355 nm) je možné indukovat dvouřetězcové zlomy v definovaných oblastech DNA a poté přímo v živých buňkách zkoumat procesy opravy DNA na úrovni chromatinu (Obr. 3).
Imunocytobarvení
Technika imunofluorescenčního barvení pomocí specifických protilátek se používá pro vizualizaci buněčných proteinů. Tuto metodu lze použít i v kombinaci s FISH nebo technikou transfekce (GFP fúzní protein). V naší laboratoři se zaměřujeme převážně na studium jaderných proteinů jako jsou například proteiny histonové povahy nebo heterochromatické proteiny. Pomocí mikroskopu Leica DMRXA s vysokým rozlišením získáváme velmi kvalitní 3D obrázky jaderných struktur a v duálně barvených preparátech lze pak hodnotit míru kolokalizace proteinů.
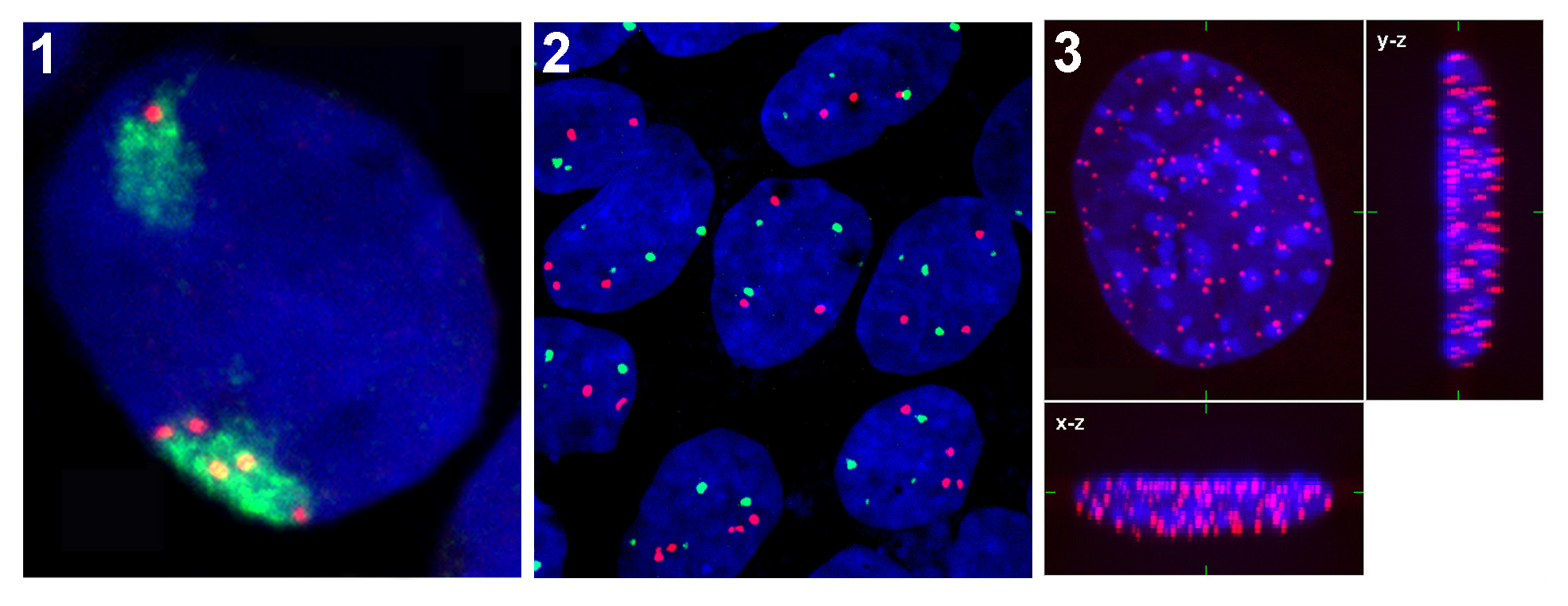
FISH(Fluorescenční In Situ Hybridizace)
Pomocí FISH techniky v naší laboratoři detekujeme různé části genomu jako například chromozomální teritoria, jednotlivé geny, ale i centromerické a telomerické oblasti chromozómů. Pro získávání 3D obrazu je používán konfokální systém obsahující epifluorescenční mikroskop Leica DMRXA, konfokální jednotku QLC100 s Nipkowovým diskem a argon-kryptonový laser jako zdroj světla. Speciálním softwarem Acquiarium jsme pak schopni analyzovat radiální distribuce genetických elementů v buněčném jádře (Matula et al. 2009).